2023년 7월 11일 치뤄진 인천교육청 주관 전국연합 모의고사 화학1 4페이지 19번 풀이입니다.
19. 화학반응식의 양적관계
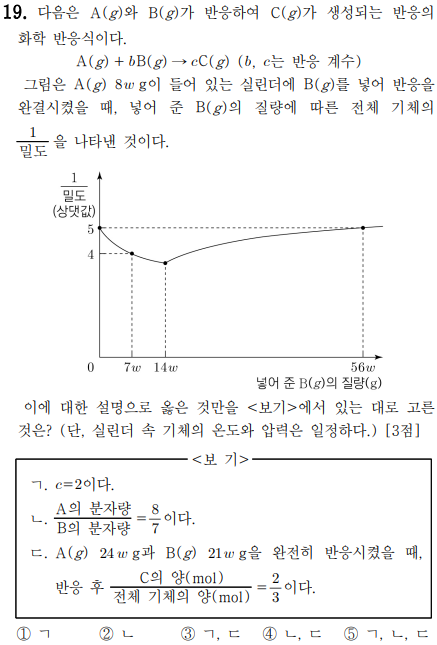
화학반응식의 양적관계를 다루는 문제로 흔히 말하는 킬러 문항이지요. 다만 점점 킬러 문항의 난이도가 낮아지고 있는 추세이며, 수능 출제 방향이 킬러문항을 배제한다고 하니 불필요하게 복잡한 문항들은 없어질 것 같습니다.
우선 (1/밀도)이 뜻하는 바를 알아야 하는데요. (1/밀도)은 (부피/질량)으로 나타낼 수 있고 질량에 대한 정보가 주어져 있으니 질량을 곱하면 부피의 상댓값을 알아낼 수 있습니다.
여기서 부피는 바로 몰수에 비례하지요. 즉, 복잡해 보이지만 각 지점에서의 전체 몰수를 알려주고 있다고 보시면 됩니다.
따라서 각 지점의 몰수(상댓값)는 다음과 같습니다.
| 넣어준 B의 질량 | 0 | 7w | 56w |
| 전체 몰수 | 5*8w =40w | 4*15w =60w | 5*64w =320w |
또한 그래프가 14w를 넣어준 이후부터는 증가하는 모습으로 보아 B를 14w 넣어 주었을 때 A가 모두 반응함을 알 수 있습니다.
이러한 조건들을 이용하여 반응 전후의 양적 관계를 구해보면 다음과 같습니다.
먼저 B를 7w 넣어주었을 때는 A가 절반만큼 반응합니다.
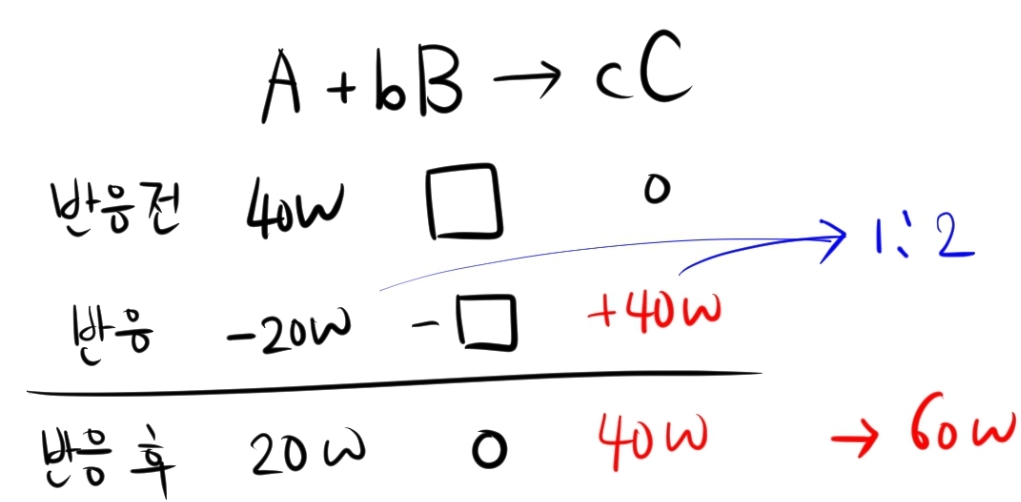
따라서 c=2 임을 알 수 있습니다.
다음으로 B를 56w 넣어주었을 때의 양적 관계입니다.

b=2입니다.
ㄴ. 분자량=(질량/몰수) 임을 이용하여 분자량의 상댓값을 구할 수 있습니다.
A의 분자량 = 8w/40w = 1/5
B의 분자량 = 14w/80w = 7/40 입니다.
ㄷ. 에서 A 24w g은 120w 몰이고 B 21w g은 120w 몰입니다. A, B, C의 반응비는 1:2:2 이므로 반응 후, A 60w 몰과 C 120w 몰이 남게 됩니다.
19번과 같은 화학반응식의 양적관계 문제는 반응 전, 반응, 반응 후 각 물질의 몰수를 구해주면 해결되는 문제입니다.
보통 질량이 주어지면 조금 어려울 수 있지만 각각의 몰수를 구하는 것을 목표로 차근차근 해결하시면 됩니다.
다만 이때 가능한 미지수를 만들지 말아주세요. 미지수가 많아질수록 복잡하고 실수할 확률이 올라간답니다.

'공부합시다 > 화학 모의고사' 카테고리의 다른 글
| 2024학년도 9월 모의고사 화학1 20번[화학반응 양적관계] (0) | 2023.09.06 |
|---|---|
| 2023년 7월 전국연합 모의고사 화학1 20번 풀이 및 해설 (0) | 2023.07.16 |
| 2023년 7월 전국연합 모의고사 화학1 17번, 18번 풀이 및 해설 (0) | 2023.07.14 |
| 2023년 7월 전국연합 모의고사 화학1 14번 ~ 16번 풀이 및 해설 (2) | 2023.07.13 |
| 2023년 7월 전국연합 모의고사 화학1 11번 ~ 13번 풀이 및 해설 (0) | 2023.07.12 |



